مبانی اندازه گیری ORP
مبانی اندازه گیری ORP چیست؟
ORP چیست؟
ORP مخفف پتانسیل اکسایش-کاهش است که بر حسب میلی ولت معیاری از تمایل یک ماده شیمیایی به اکسید شدن یا کاهش یک ماده شیمیایی دیگر است.
اکسایش
اکسیداسیون از دست دادن الکترون توسط یک اتم، مولکول یا یون است. ممکن است با افزودن اکسیژن همراه باشد یا نباشد، که منشاء این اصطلاح است. نمونه های آشنا زنگ زدن آهن و سوزاندن چوب است.
وقتی ماده ای اکسید می شود، حالت اکسیداسیون آن افزایش می یابد.
بسیاری از مواد می توانند در چندین حالت اکسیداسیون وجود داشته باشند. یک مثال خوب گوگرد است که می تواند حالت های اکسیداسیون -۲ (H2S) را نشان دهد. ۰ (S)؛ +۴ (SO2)؛ و ۶+ (SO4 -2).
مواد با حالت های اکسیداسیون متعدد می توانند به طور متوالی از یک حالت اکسیداسیون به حالت اکسیداسیون بعدی اکسید شوند. حالات اکسیداسیون مجاور یک ماده خاص به عنوان زوج ردوکس نامیده می شود.
در مورد زیر، زوج ردوکس Fe+2/Fe است:
کلاس
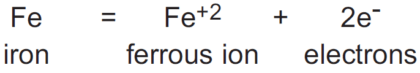
معادله شیمیایی نشان داده شده در بالا، نیمه واکنش برای اکسیداسیون نامیده می شود، زیرا همانطور که مشاهده خواهد شد، الکترون های از دست رفته توسط اتم آهن نمی توانند در محلول وجود داشته باشند و باید در محلول باشند. توسط ماده دیگری در محلول پذیرفته می شود.
بنابراین واکنش کامل شامل اکسیداسیون آهن باید حاوی ماده دیگری باشد که کاهش می یابد.
بنابراین، واکنش اکسیداسیون نشان داده شده برای آهن تنها نیمی از کل واکنشی است که انجام می شود.
کاهش
کاهش افزایش خالص الکترون ها توسط یک اتم، مولکول یا یون است.
وقتی یک ماده شیمیایی کاهش می یابد، حالت اکسیداسیون آن کاهش می یابد.
همانطور که در مورد اکسیداسیون وجود داشت،
موادی که می توانند چندین حالت اکسیداسیون را نشان دهند نیز می توانند به طور متوالی از یک حالت اکسیداسیون به حالت اکسیداسیون پایین بعدی کاهش یابند.
معادله شیمیایی نشان داده شده در زیر نیمه واکنش برای کاهش کلر است:
کلاس

زوج ردوکس در مورد فوق Cl2/Cl- (کلر/کلرید) است.
واکنش های اکسیداسیون همیشه با واکنش های کاهشی همراه است.
الکترون های از دست رفته در اکسیداسیون باید ماده دیگری به عنوان مقصد داشته باشند و
الکترونهایی که در واکنشهای کاهشی بهدست میآیند باید از یک منبع بیایند.
وقتی دو نیمه واکنش با هم ترکیب می شوند تا واکنش کلی را نشان دهند،
الکترون های از دست رفته در واکنش اکسیداسیون باید با الکترون های به دست آمده در واکنش احیا برابری کنند.
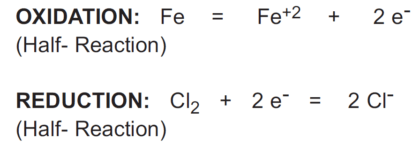
کلاس
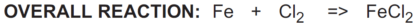
در واکنش بالا، آهن (Fe) کلر (Cl2) را کاهش می دهد و به آن کاهنده یا عامل کاهنده می گویند.
برعکس، کلر (Cl2) آهن (Fe) را اکسید می کند و اکسید کننده یا عامل اکسید کننده نامیده می شود:
عوامل اکسید کننده و کاهنده
پتانسیل استاندارد
چقدر یک ماده به راحتی اکسید یا احیا می شود توسط پتانسیل استاندارد زوج ردوکس آن مشخص می شود که با علامت E° نشان داده شده است.
پتانسیل استاندارد تعداد زیادی از زوج های ردوکس در کتاب های مرجع به همراه واکنش های نیمه آنها جدول بندی شده است. همه به زوج ردوکس برای یون هیدروژن/هیدروژن (H+/H2) ارجاع داده می شوند که پتانسیل استاندارد ۰ میلی ولت به آن اختصاص داده شده است.
پتانسیل استاندارد به نیمه واکنش اشاره دارد که به صورت کاهش نوشته شده است.
منفی پتانسیل استاندارد جدول بندی شده پتانسیل استاندارد را برای نیمه واکنش اکسیداسیون می دهد.
نمونه ای از این موارد به شرح زیر است:
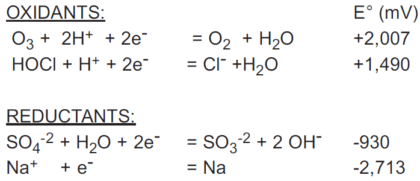
ORP در Solutions
پتانسیل استاندارد برای یک نیمه واکنش بر این فرض استوار است که غلظت تمام مواد شیمیایی نشان داده شده در نیمه واکنش در غلظت ۱ مولی است.
با این حال، در یک فرآیند، غلظت ها می توانند مستقل از یکدیگر متفاوت باشند.
بنابراین، برای رسیدن به ORP یک راه حل خاص، لازم است از معادله Nernst برای محاسبه ORP برای هر مورد استفاده شود.
معادله NERNST برای ORP
ORP یک نیمه واکنش عمومی را می توان بر حسب غلظت مولی به صورت زیر نوشت:
aA+bB+cC+ …+ ne- = xX+yY+zZ + …
اسید هیپوکلروس (کلر در آب) مثال مفیدی از معادله نرنست ارائه می دهد:
کلاس

بررسی معادله هیپوکلرو اسید/کلرید برخی از ویژگی های مهم ORP را نشان می دهد:
۱٫ ORP به غلظت تمام مواد در نیمه واکنش (به جز آب) بستگی دارد.
بنابراین، ORP اسید هیپوکلرو
به همان اندازه که به اسید هیپوکلروس بستگی دارد به یون کلرید (Cl-) و pH (H+) بستگی دارد.
۲٫ ORP تابعی از لگاریتم نسبت غلظت است.
۳٫ ضریبی که این لگاریتم غلظت را ضرب می کند برابر با ۱۶/۵۹- میلی ولت است که بر تعداد الکترون های نیمه واکنش (n) تقسیم می شود. در این مورد، n = 2; بنابراین ضریب ۲۹٫۵۸- است.
تغییر ۱۰ برابری در غلظت Cl-، HOCl، H+ فقط ORP را ۲۹٫۵۸mV ± تغییر می دهد.
۴٫ هیچ وابستگی خاصی به دما نشان داده نشده است.
دما می تواند واکنش ORP را به طرق مختلف تحت تاثیر قرار دهد، بنابراین هیچ رفتار دمایی ORP کلی را نمی توان مشخص کرد، همانطور که در مورد pH وجود دارد.
بنابراین، اندازهگیریهای ORP تقریباً هرگز دما را جبران نمیکنند.
هنگام بررسی تأثیر یک ماده منفرد در نیمه واکنش، می توان معادله نرنست را به لگاریتم های جداگانه برای هر ماده تقسیم کرد و سهم آن ماده را بر غلظت مورد انتظار آن محاسبه کرد. محدوده.
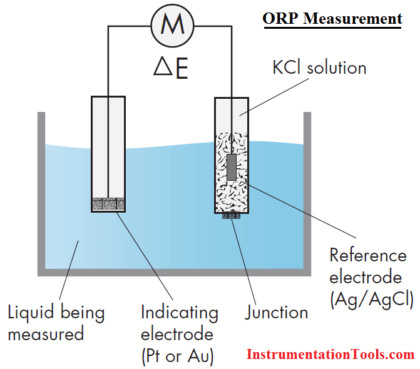
اندازه گیری ORP
یک حسگر ORP از یک الکترود ORP و یک الکترود مرجع تشکیل شده است، تقریباً مانند اندازه گیری pH.
الکترود ORP
اصل پشت اندازه گیری ORP استفاده از یک الکترود فلزی بی اثر (پلاتین، گاهی اوقات طلا) است که به دلیل مقاومت کم، الکترون ها را به یک اکسید کننده می دهد یا الکترون ها را از یک احیا کننده می پذیرد.
الکترود ORP به پذیرش یا رها کردن الکترونها ادامه میدهد تا زمانی که یک پتانسیل ایجاد کند، به دلیل بار ایجاد شده، که برابر با ORP محلول است.
دقت معمول اندازه گیری ORP ± ۵ میلی ولت است.
گاهی اوقات تبادل الکترون بین الکترود ORP و مواد شیمیایی خاص به دلیل نرخ کم تبادل الکترون (چگالی جریان تبادل) با مشکل مواجه میشود.
در این موارد، ORP ممکن است با شدت بیشتری به یک زوج ردوکس دوم در محلول (مانند اکسیژن محلول) پاسخ دهد. این منجر به خطاهای اندازه گیری می شود و توصیه می شود که برنامه های ORP جدید قبل از آنلاین شدن در آزمایشگاه بررسی شوند.
الکترود مرجع
الکترود مرجع مورد استفاده برای اندازه گیری ORP معمولاً همان الکترود نقره-کلرید نقره است که برای اندازه گیری pH استفاده می شود.
برخلاف اندازهگیریهای pH، مقداری افست در مرجع در ORP قابل تحمل است،
زیرا همانطور که مشاهده خواهد شد، تغییرات mV اندازهگیری شده در اکثر برنامههای ORP زیاد است.
در برخی کاربردهای خاص (به عنوان مثال، تولید سفید کننده)، یک سنسور ORP ممکن است از یک شمش نقره به عنوان مرجع یا حتی یک الکترود pH استفاده کند.
کلاس

برنامه ها
به دلیل وابستگی آن به غلظت چندین ماده شیمیایی، استفاده از ORP برای بسیاری تجربه گیج کننده و اغلب خسته کننده بوده است.
هنگام در نظر گرفتن ORP برای یک کاربرد خاص، لازم است نیمه واکنش درگیر و محدوده غلظت همه مواد ظاهر شده در نیمه واکنش را بدانید.
همچنین لازم است از معادله Nernst برای دریافت ایده ای از رفتار ORP مورد انتظار استفاده شود.
اندازه گیری غلظت با ORP
ORP اغلب برای اندازه گیری غلظت (مثلاً کلر در آب) بدون درک روشنی از همه عوامل دخیل استفاده می شود. هنگامی که معادله ORP یک محلول هیپوکلری (در بخش قبل) در نظر گرفته می شود،
مشکلات مربوط به اندازه گیری غلظت را می توان تشریح کرد:
۱٫ ORP به همان اندازه که به اسید هیپوکلروس (کلر در آب) بستگی دارد به یون کلرید (Cl-) و pH (H+) بستگی دارد. هر گونه تغییر در غلظت کلرید یا pH بر ORP تأثیر می گذارد.
بنابراین، برای اندازهگیری دقیق کلر، یون کلرید و pH باید با دقت بالایی اندازهگیری شوند یا به دقت تا مقادیر ثابت کنترل شوند.
۲٫ برای محاسبه غلظت هیپوکلری از میلی ولت های اندازه گیری شده، میلی ولت اندازه گیری شده به عنوان توان ۱۰ ظاهر می شود. دقت معمول اندازه گیری ORP 5± میلی ولت است.
این خطا به تنهایی منجر به کاهش غلظت اسید هیپوکلرو محاسبه شده بیش از ۳۰ ± می شود. هر گونه رانش در الکترود مرجع یا تحلیلگر ORP فقط به این خطا اضافه می کند.
۳٫ هر گونه تغییر در ORP با دما جبران نمی شود و خطا در غلظت مشتق شده بیشتر می شود.
به طور کلی، ORP تکنیک خوبی برای استفاده در اندازه گیری غلظت نیست.
تقریباً تمام نیمه واکنش های ORP شامل بیش از یک ماده است و اکثریت قریب به اتفاق دارای وابستگی به pH هستند. وابستگی لگاریتمی ORP به غلظت، خطاهای موجود در میلی ولت اندازه گیری شده را چند برابر می کند.
برنامه های ORP
برنامههایی که از ORP برای نظارت و کنترل واکنشهای کاهش اکسیداسیون استفاده میکنند شامل تخریب سیانید، کلرهزدایی، احیای کرومات، تولید سفیدکننده هیپوکلریت و نظارت بر اسکرابر کلر و دی اکسید کلر با استفاده از بی سولفیت است.
اندازه گیری غلظت با ORP، همانطور که مشاهده شد، مشکل ساز است،
اما ORP را می توان در برخی موارد برای تشخیص نشت برای تشخیص وجود یک اکسیدان یا احیا کننده استفاده کرد.
در نهایت، ORP در برخی موارد برای کنترل رشد بیولوژیکی اندازه گیری می شود.
اصل پشت این کاربردها این است که حداقل مقدار ORP با موفقیت میکروارگانیسم ها را از بین می برد. این روش در کلرزنی استخرها و برج های خنک کننده استفاده شده است.
لازم به ذکر است که هر دوی این برنامه ها شامل کنترل pH نیز می شوند.
نتیجه گیری
پتانسیل اکسیداسیون-کاهش یک محلول معیاری از قدرت اکسیداسیون یا کاهشی محلول است.
هر اکسیداسیون یا کاهش را می توان با یک نیمه واکنش مشخص کرد که تمام مواد شیمیایی شرکت کننده در واکنش را به دست می دهد. ORP محلول به لگاریتم غلظت مواد شرکت کننده در نیمه واکنش بستگی دارد.
ORP را می توان با استفاده از معادله نرنست محاسبه کرد.
او آر پی به دلیل وابستگی لگاریتمی به غلظت و وابستگی آن به اجزای متعدد محلول روش مناسبی برای اندازه گیری غلظت نیست.
بهترین استفاده از اندازه گیری ORP در نظارت و کنترل واکنش های کاهش اکسیداسیون است.
در صورت هرگونه سوال و نظر با مجموعه پرگاران تماس حاصل فرمایید.
جهت کسب اطلاعات بیشتر اینجا کلیک کنید.
مطالب مرتبط
نرم افزار شبیه سازی ۶ محوره چیست؟

اندازه گیری دمای تصویربرداری حرارتی